Letgen Biyoteknolojinin önemli partnerlerinden birisi olan Microsynth, özellikle nükleik asit sentezi ve analizi alanında Avrupa’nın önde gelen şirketlerinden biridir. 1989 yılından bu yana, biyoteknoloji ve ilaç endüstrilerinde yenilikçi çözümler sunarak araştırmacıların güvenilir ortağı olmuştur. Kurulduğu günden itibaren oligonükleotit sentez ve tasarımı, 1992 yılından beri Sanger DNA sekanlamada ve 2007 yılından beri NGS hizmetleri konusunda oldukça başarılı hizmet vermektedir. Avrupa’nın çeşitli noktalarında konumlandırılmış laboratuvarları sayesinde Microsynth, yüksek kalitedeki hizmetlere kısa yoldan ulaşım imkânı sunar. Peki, Microsynth’i diğerlerinden ayıran ve tercih edilmesini sağlayan özellikler nelerdir?
Neden Microsynth’i tercih etmelisiniz?
Microsynth, araştırma ve laboratuvar ihtiyaçlarınızı karşılamak için kapsamlı bir hizmet yelpazesi sunar. Sadece DNA dizileme değil, aynı zamanda izolasyon, PCR, probe ve primer tasarım gibi bir dizi hizmetle her zaman yanınızdadır. Alanında uzman kişilere doğrudan erişim sağlayarak projelerinizde size rehberlik eder. Verilerinizi anlamlı ve işlenebilir hale getirmek ve anlamlandırabilmek için güçlü bir biyoinformatik altyapısına sahiptir. Analiz sonuçlarınızı bilimsel keşiflere dönüştürebilmek için ilk adımı Microsynth ile atın. Ayrıca projenizin ihtiyaçlarını anlayan ve hassas bir şekilde karşılayan kapsamlı danışmanlık hizmeti sunuyor. Siz projenize odaklanın, bırakın tüm detayları Microsynth sizin için halletsin. Tüm bu avantajlar ve kaliteli hizmet uygun fiyat ile bir araya geliyor. Kaliteden ödün vermeden bütçe dostu hizmet arayanlar için Microsynth, bilimsel başarıya giden yolda yapabileceğiniz en akıllıca bir tercihlerden birisi olarak sizi selamlıyor.
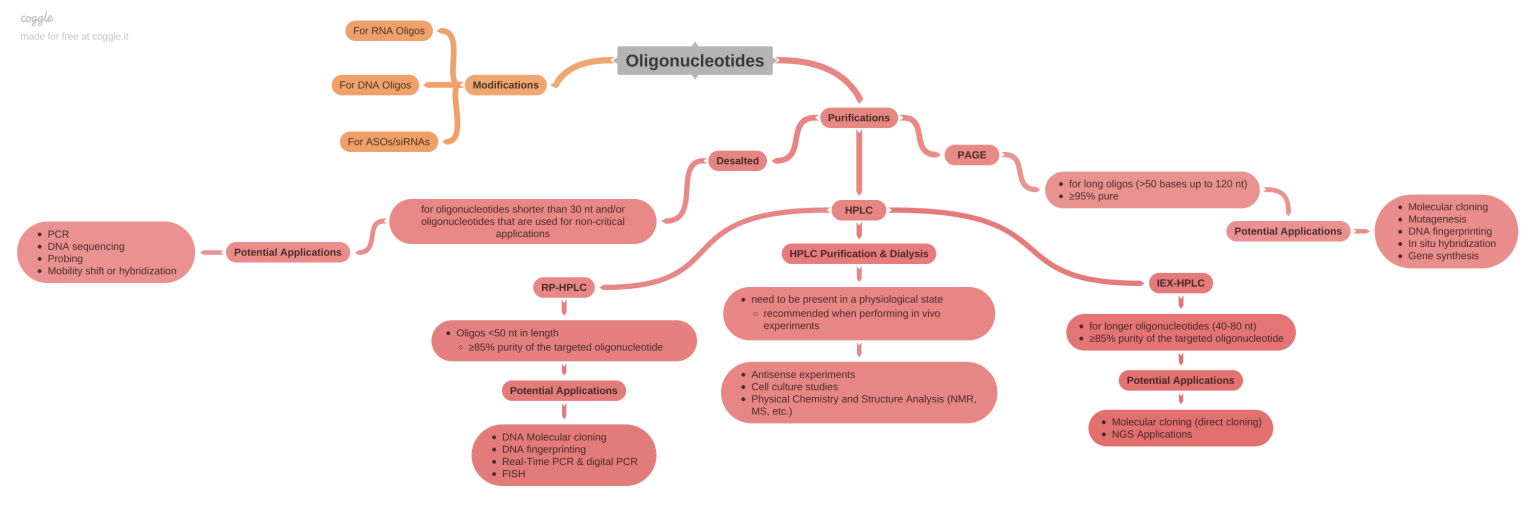
DNA/RNA Oligonükleotit ve Prob Sentezi/Tasarımı
Microsynth, genetik araştırmalarınızda ve moleküler biyoloji çalışmalarınızda size özel oligonucleotit sentezi ve tasarımı konusunda lider bir hizmet sağlayıcısıdır. Özelleştirilmiş oligonükleotidler, primerler ve prob tasarımı ile araştırmalarınıza hız kazandırır. İster küçük ölçekli bir proje üzerinde çalışıyor olun, ister büyük bir araştırma yürütüyor olun, Microsynth’in yüksek kaliteli sentez hizmetleri ihtiyaçlarınıza mükemmel bir şekilde uyum sağlar. Kalite, güvenilirlik ve bilimsel başarı için Microsynth’i tercih edin!
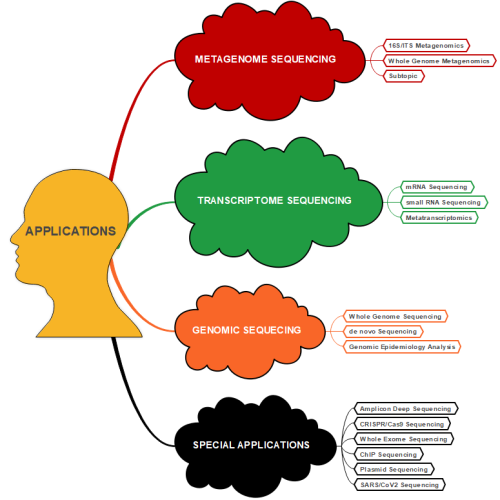
DNA/RNA Analizi ve Dizileme
Microsynth, DNA ve RNA analizi ve dizileme hizmetlerinde de öncüdür. Şirket, yüksek çözünürlüklü dizileme hizmetleri (NGS) ve uzman bioinformatik analizler sunmaktadır. Microsynth’in NGS hizmetleri, DNA/RNA izolasyonu, kütüphane hazırlığı, sekanslama ve ileri düzey bioinformatik analizleri kapsayan standart her şey dahil hizmetler sunar. Microsynth, Illumina ve Oxford Nanopore Technologies (ONT) gibi çeşitli platformlarda derinlemesine uzmanlığa sahiptir. Illumina ve Oxford Nanopore Technologies (ONT) gibi platformlarda sunduğu hizmetlerle, DNA, RNA veya PCR ampliconlarının genetik bilgilerini hızla çözümlemeye katkı sağlar. Ayrıca Microsynth sürekli olarak hizmetlerini geliştirmekte ve yenilikçi çözümler sunmaktadır. Şirket, GridION ve PromethION 2 Solo cihazları için ONT sertifikalı hizmet sağlayıcısıdır. Bu sertifikalar, Microsynth’in yüksek kaliteli ve güvenilir hizmetler sunduğunun bir göstergesidir. Bu hizmetler, yüksek kalite, hızlı geri dönüş süreleri, rekabetçi fiyatlar ve mükemmel müşteri desteği ile öne çıkar.
Sözleşmeli Araştırma ve Dış Kaynak Kullanımı
Microsynth, biyoteknoloji ve ilaç endüstrilerine yönelik özelleştirilmiş araştırma ve dış kaynak kullanımı hizmetleri sunmaktadır. Şirket, GxP uyumlu analitik testler ve biyolojik ilaçlar için değerli içgörüler sağlar. Ayrıca, Microsynth’in yeni geliştirdiği miCORE Resequencing NGS hizmeti, yüksek standartlarda yeniden dizileme hizmeti sunarak araştırmalarınıza değer katar.
Müşteri Odaklı Yaklaşım
Microsynth, 30 yılı aşkın deneyimi ve uzman kadrosu ile biyoteknoloji ve ilaç endüstrilerinde güvenilir bir ortaktır. Şirket, Illumina ve Oxford Nanopore Technologies (ONT) gibi platformlarda derinlemesine uzmanlığa sahiptir ve bu sayede müşterilerine en iyi sonuçları sunar. Ayrıca müşteri memnuniyetini her zaman ön planda tutar. Müşterilerinin ihtiyaçlarına özel çözümler sunarak, araştırma projelerinin başarısını destekler. Microsynth’in sunduğu hizmetler, araştırma süreçlerinizi hızlandırır ve sonuçlarınızı daha güvenilir hale getirir. Müşteri hizmetleri ekibi, her adımda size destek olmak için hazırdır.
Sonuç olarak Microsynth, nükleik asit sentezi ve analizi alanında sunduğu geniş hizmet yelpazesi ile araştırma projelerinizi bir üst seviyeye taşır. Yüksek kaliteli ürünler, yenilikçi çözümler ve müşteri odaklı yaklaşımı ile Microsynth, biyoteknoloji ve ilaç endüstrilerinde güvenilir bir ortaktır. Microsynth ile çalışarak, araştırmalarınızda fark yaratın!