- Home
- Kanser
Kişiselleştirilmiş Tıp Yaklaşımında Car-T Hücreleri ve CRISPR
Kişiselleştirilmiş Tıp, ülkemizde gündelik hayatta kendi adından sıkça bahsettirmese dahi tıp ve araştırma alanlarında artık norm olmuş bir kavram olarak ilerlemektedir. Kavramın temelleri 1999 yılında The Wall Street Journal’da küçük bir makalede1 atılmış, pratik anlamda uygulamaya geçilmesi teknolojinin de kısıtlamaları nedeniyle ilerleyen yıllarda gerçekleşmiştir. Günümüzde artan teknolojik cihazlar ve analiz yöntemlerinin çeşitlenmesi ve özellikle sekanslama yöntemlerinin gelişmesiyle araştırmalar hız kazanmış, bununla beraber kazanılan bilginin kümülatif olarak çoğalması detaylı çalışmalara olanak sağlamıştır. Terimin ilk kez kullanıldığı 1999 yılındaki mini yayında bile dikkatleri üzerine çekerek onkoloji alanındaki muhteşem potansiyelinin fark edilmesiyle aynı yayın The Oncologist’te tekrar yayınlanmıştır. Şu anda ise Kişiselleştirilmiş Tıp uygulama ve araştırmalarının çoğunlukla onkoloji alanında yapılması ise bir tesadüf değil, aksine kanserin temelde kişiye özel oluşum ve seyri olmasından kaynaklanmaktadır.
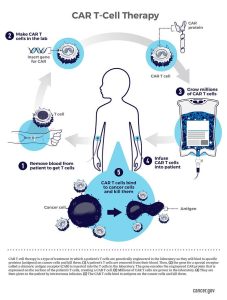
Bu alanda gerçekleştirilmiş olan son çalışmaları özetlemek için ise Ocak 2023’te Nature’da yer alan CAR-T Cells yazısı incelenebilir. Yazıda özellikle lösemi tedavisinde kullanılan CAR-T hücrelerinin etkinliğini vurgulamaktadır. CAR-T hücrelerinin nasıl çalıştığına ve kanser hücrelerini nasıl hedeflediğine ayrıntılı bir şekilde değinilip buna ek olarak ayrıca, CAR-T hücrelerinin geliştirilmesi için geçmişte ve bugün yapılan araştırmaların tarihçesi de incelenmektedir. CAR-T hücrelerini kısaca açıklamak gerekirse eğer, bu hücreler kanser hücrelerine özgü bir antijeni tanıyan bir reseptörü içeren T hücreleridir. Bu reseptör, kanser hücrelerinin yüzeyindeki belirli bir protein ya da antijenle bağlanarak kanser hücrelerinin yok edilmesini sağlar. CAR-T hücrelerinin geliştirilmesi aşamasında, T hücreleri kanser hücrelerine özgü antijenleri tanıyabilen yapay bir reseptörle donatılmaktadır. Bu reseptör, bir antijen bağlanma bölgesi ve T hücresinin içinde kanser hücrelerini hedeflemek için gerekli olan bir dizi sinyal verici molekül içermektedir. CAR-T hücrelerinin kanser hücrelerine özgü antijenleri hedefleyebilmesi, sağlıklı hücreleri etkilemeden kanser hücrelerini yok edebilmesi açısından önemlidir. Ancak, CAR-T hücreleri bazen sağlıklı hücreleri de hedef alabilirler. Bu durum, tedavinin potansiyel yan etkilerinden biridir ve araştırmacılar, bu yan etkilerin azaltılması için çalışmalar yürütmektedirler. Özellikle her bir hastanın ayrı bir case olarak ele alınması gerektiği kanser tedavisinde modifiye edilmiş CAR-T yaklaşımları heyecan yaratmaktadır. Hücreleri modifiye ederek hem kişiye özel tedavi yaklaşımı hem de sadece kanser hücresini hedef alması sağlanarak, tedaviye yanıt almanın yanında toksisite en aza indirilmeye çalışılmaktadır.
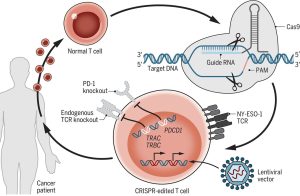
CAR-T hücrelerinin geliştirilmesi ve hedef bölgelerine daha spesifik hale gelmesi için ise alanında çığır açmış olan CRISPR teknolojisinin potansiyeli dikkatleri üzerine çekmektedir. Nature’da yayınlanan CAR-T yazısında da CRISPR sayesinde sadece kanser hedefleyip yok edebilen teröpatik yaklaşımların ilerideki dönemlerde yüksek ihtimalle daha yaygınlaşacağını vurgulamaktadır. Yazıda verilen bir örnekte ise Gladstone Institute’te görevli olan immünolog Alexander Marson CRISPR teknolojisini kullanarak T hücrelerinde binlerce geni susturup/aktive ederek vücudumuzda yüksek düzeyde önem taşıyan bağışıklık düzenleyici olarak görev alan sitokinlerin üretilme durumlarını incelemiştir. Aynı çalışma ekibi başka bir çalışmasında ise RASA2 adlı bir proteinin aktivitesini azaltmanın, CAR-T hücrelerinin hedeflerini öldürme yeteneğini geliştirdiğini buldu. Yapılan çalışmalar ve bulgular her ne kadar umut verici olsa da aşılması gereken önemli engeller halen daha bulunmaktadır.
Marson’ın şu sözü günümüz çalışmalarını özetlemektedir; “T hücrelerini istediğimiz gibi davranması için ayarlayabileceğimiz ve azaltabileceğimiz genler hakkında dersler alıyoruz.” Aslında tam olarak CRISPR teknolojisi bizlere genlerin potansiyellerini ve etki alanlarını kavramamızı ve onları değiştirme imkanını sunmaktadır.
Partneri olduğumuz İsviçre merkezli Microsynth firması CRISPR çalışmaları alanında geniş bir yelpaze ile araştırmacılara yardım etmektedir. Assay geliştirme ve validasyon dahil olmak üzere, Cell Line/ Cell bank testing hizmeti sunmasının yanında CRISPR editin analysis, Off-Target Analysis ve rAAV Characterization hizmetleri sunmaktadır.
Eğer sizler de bu alana katkı sunmak veya CRISPR teknolojisini kendiniz deneyimlemek isterseniz bizlere info@letgenbio.com adresinden her zaman ulaşabilirsiniz.
CRISPR hizmeti ile sınırlı kalmayarak aynı zamanda tüm NGS hizmetleri ile de dünya çapında hizmet vermektedir. Yeni Nesil Sekanslamaya ek olarak Sanger Sekans hizmeti hakkında da bilgi almak için bizlere ulaşabilirsiniz. Projeniz için gereken en doğru yaklaşımı karşılıklı fikir alışverişinde bulunarak beraber karar verebiliriz.
Referanslar:
- Jørgensen, J.T. (2019) “Twenty years with Personalized Medicine: Past, present, and future of individualized pharmacotherapy,” The Oncologist, 24(7). Available at: https://doi.org/10.1634/theoncologist.2019-0054.
- Nature | Vol 613 | 26 January 2023 “HOW CAR-T CELLS BECAME THE HOT RODS OF CANCER THERAPY”
Kanser
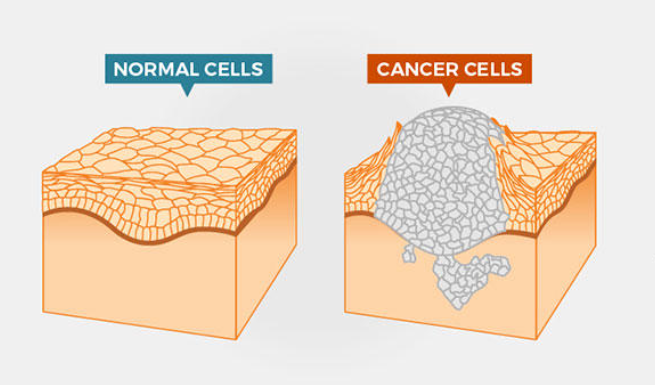
Kanser, en yalın tanımıyla hücrelerin anormal büyüme ve proliferasyon göstererek hem kendini hem de çevresindeki hücreleri etkileyen bir durum olarak tanımlanabilir. Vücudun herhangi bir yerinde başlayıp diğer doku veya organlara yayılabilirler. Normal hücreler doğar, büyür ve ölürken kanser hücreleri ise doğarlar, büyürler, biraz daha büyürler ve anormal şekilde büyümeye devam ederek sonunda diğer hücrelere yayılırlar.
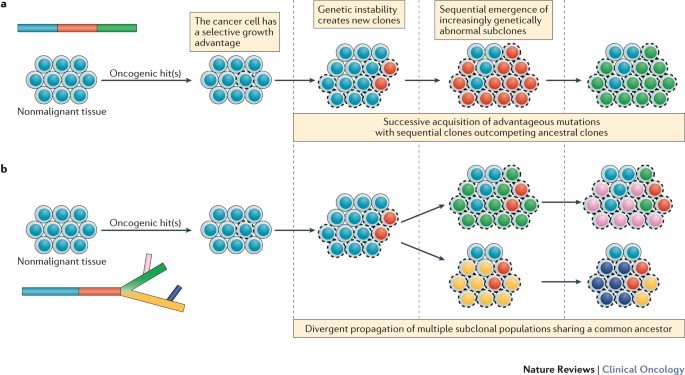
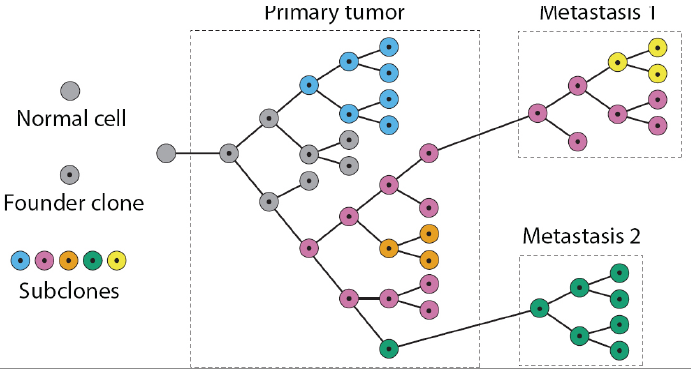
Yani daha basit tabirle, fenotipte meme kanseri veya herhangi bir tür kansere sahip olarak gözüken iki kişinin aslında genotiplerinde, yani kansere sahip olmalarının altında yatan genetik sebeplerde farklılık olabilir. Kanser tedavisinde çeşitli yöntemler kullanılmaktadır, bunlara örnek olarak kemoterapi (chemotherapy-chemo drugs), ameliyat, immunoterapi veya Targeted therapy gösterilebilir. En yaygın olarak bilinen kemoterapik ilaçların ise toksisitesi yüksektir. Bu nedenle kanser hastalarında genellikle belirli sayıdan fazla farklı çeşitteki kemoterapik ilaç denemesinden ileriye geçilmez, çünkü kemoterapik ilaçlar kanser hücrelerini öldürmeye/baskılamaya çalışırken sağlıklı normal hücrelere de zarar verebilmektedir. İnsan vücudunun kaldırabileceği belirli bir toksisite seviyesi bulunmasından dolayı kemotrerapiye alternatif olarak kanser tedavisinde kullanılmak üzere çeşitli yöntemler geliştirilmeye çalışılmaktadır. İşte tam olarak bu noktada genetik analiz araştırma ve çalışmalarının önemi ortaya çıkmaktadır. Gen analizinden önce, hangi genlerin kansere neden olduğu ve normal hücrelerin nasıl kanserli hücrelere dönüştüğü belirsizdi. Genetik analizler bu kadar yaygın olmadan önce genotipteki farklılıkların es geçilmesinden dolayı aynı fenotipi gösteren hastalara aynı ilaçlar verilmekte ve tedaviye yanıt alınamamaktaydı. Günümüzde gelişen teknoloji sayesinde sekanslama yöntemlerinin çeşitlenerek ve maliyetinin de düşmesiyle, genetik araştırmalar daha ulaşılabilir ve yaygın hale gelmiş bulunmaktadır. Bu da doğal olarak alanda yapılan çalışma ve tedavi yöntemlerini çeşitlendirmiştir.
Genetik analiz araştırmalarında akıllara ilk gelen ve etkisini araştırma alanında muhteşem bir şekilde hissettiğimiz Next Generation Sequencing yani Yeni Nesil Sekanslama yöntemi karşımıza çıkmaktadır. En kısa tabirle, çok sayıda örneği farklı platformlar kullanarak aynı anda sekanslamak için kullanılan tekniklere verilen isimdir. Çok sayıdaki örnek aynı anda paralel olarak sekanslandığı için bu yönteme “paralel sekanslama” da denilmektedir. Milyonlarca ila milyarlarca DNA nükleotidi paralel olarak sıralanabilmektedir. Giga baz boyutta okumaları oluşturmak için gereken süre yalnızca birkaç gün veya saattir(Kchouk et al., 2017). Sanger veya diğer çeşitli sekanslama yöntemlerine karşı gösterdiği hız ve doğruluk payı sayesinde şu an günümüzde NGS birçok araştırma çalışmalarında kullanılmaktadır. En küçük mutasyonları bile tespit edebilme özelliğine sahip olmasından dolayı kanser araştırmalarında sıkça başvurulan yöntemlerden biridir. Buna örnek olarak Whole Exosome Sequencing(WES) gösterilebilir. WES, hastalıkla ilişkili genlerdeki mutasyonları ortaya çıkarır. Bu nedenle hastanın belirli kanser türlerini geliştirme riskini bulmamıza yardımcı olabilir. Araştırma amaçlı NGS çalışmalarınız için bizimle iletişime geçebilir ve bilgi alabilirsiniz.
Genetik ve moleküler araştırmalarda en önemli aşamalardan biri olan örnek hazırlama aşaması ise kanser alanında da önemini korumaktadır. Kanser araştırmalarında kullanılmak üzere örnekler plasma/serum, kan veya doku gibi örnekler alınabilir. Kanser taramalarında gösterge olarak Cell-Free DNA (cf-DNA) günümüzde sıkça kullanılmaktadır. Hücresiz DNA’ya (cfDNA) periferik kanda kolayca erişebilir ve kanser teşhisi, prognostik ve terapötikler için biyobelirteçler olarak kullanılabilinmektedir. Araştırmalarınızda kullanmak üzere Norgen Biotek markasına ait Plasma/Serum Cell-Free Circulating DNA Purification kitlerimize sayfamızdan göz atabilir, sorularınız için bizimle iletişime geçebilirsiniz. Kullanımı kolay ve kısa protokolleri sayesinde şu anda birçok merkezde tercih edilen kit olma başarısını göstermektedir. Aynı markaya ait diğer Plasma/serum kitlerine ise yine sayfamızda bulunan “Ürünler” kısmından ulaşabilirsiniz.
Toplanan örnekleri stabil koşullarda saklamak için ise özellikle Norgen cf-DNA/cf-RNA Preservative Tubes Cat#63950 ürünü gözlerden kaçırılmamalıdır. Tek bir tüpte hem cf-DNA hem de cf-RNA’nın korunması ve izolasyon işlemi için hazır beklemesini sağlarken aynı zamanda, fiksatif içermeyen koruyucusu ile DNA cross-linking engellerken, cf-DNA/ct-DNA’yı oda sıcaklığında 30 gün ve 37°C’de 8 güne kadar korur ve oda sıcaklığında 30 gün boyunca cf-RNA’yı korumaktadır. Dolaşımdaki Tümör Hücrelerini (CTC’ler) ise oda sıcaklığında 14 gün boyunca koruyabilmektedir. Diğer bir artısı ise nakliye/nakliye sonrasında plazma hacmi kaybı olmamasıdır. Türkiye’nin önemli kanser araştırma enstitülerinde özellikle tercih edilen bu ürünümüz hakkında detaylı bilgi almak için bizlerle her zaman iletişime geçebilirsiniz.